Teori Atom John Dalton

Model Teori John Dalton
1. Atom digambarkan sebagai bola pejal yang sangat kecil.
2. Atom merupakan partikel terkecil yang tidak dapat dipecah
lagi.
3. Atom dari unsur yang sama memiliki sifat yang sama,sedangkan atom dari unsur berbeda memiliki massa dan sifat yang berbeda.
4.. Senyawa terbentuk jika atom bergabung satu sama lain.
5. Reaksi kimia hanya melibatkan penataan ulang atom-atom sehingga tidak ada atom yang berubah akibat reaksi kimia.
Ditunjang oleh 2 hukum alam
1. Hukum Kekekalan Massa (Hukum Lavoisier) : Massa zat sebelum dan sesudah adalah sama.
2. Hukum Perbandingan Tetap (Hukum Proust) : Perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap.
Kelemahan Model Atom Dalton
Menurut Teori Dalton nomor 5,tidak adaatom yang berubah akibat reaksi kimia nuklir,suatu atom dapat berubah menjadi atom lain.
TEORI ATOM THOMSON
Pada abad ke 18 Thomson menemukan elektron melalui eksperimennya menggunakan tabung sinar katode.
Teori atom Thomson merupakan menyempurnakan Model Atom Dalton
Atom berbentuk seperti bola pejal yang bermuatan positif dan elektron-elektron tersebar dalam bola tersebut
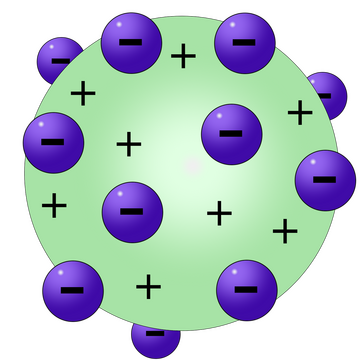
Model Atom Thomson
Analog teori atom Thomson adalah model roti kismis dengan roti sebagai atom yang bermuatan positif dan kismis sebagai elektron yang tersebar merata di seluruh bagian roti.secara menyeluruh bersifat netral.
Model atom Thomson disusun setelah dirinya menemukan elektron.
Kelemahan Model Atom ThomsonThomson telah mengemukakan gagasan tentang adanya muatan positif dalam atom.Hanya saja Thomson belum bisa menjelaskan lebih rinci mengenai muatan positif ini.
TEORI ATOM RUTHERFORD
Model atom Thomson belum mengatakan adanya inti didalam atom.Kemudian Ernest Rutherford,menemukan bukti bahwa didalam atom terdapat inti atom yang bermuatan positif.Hal ini diperoleh melalui eksperimennya.
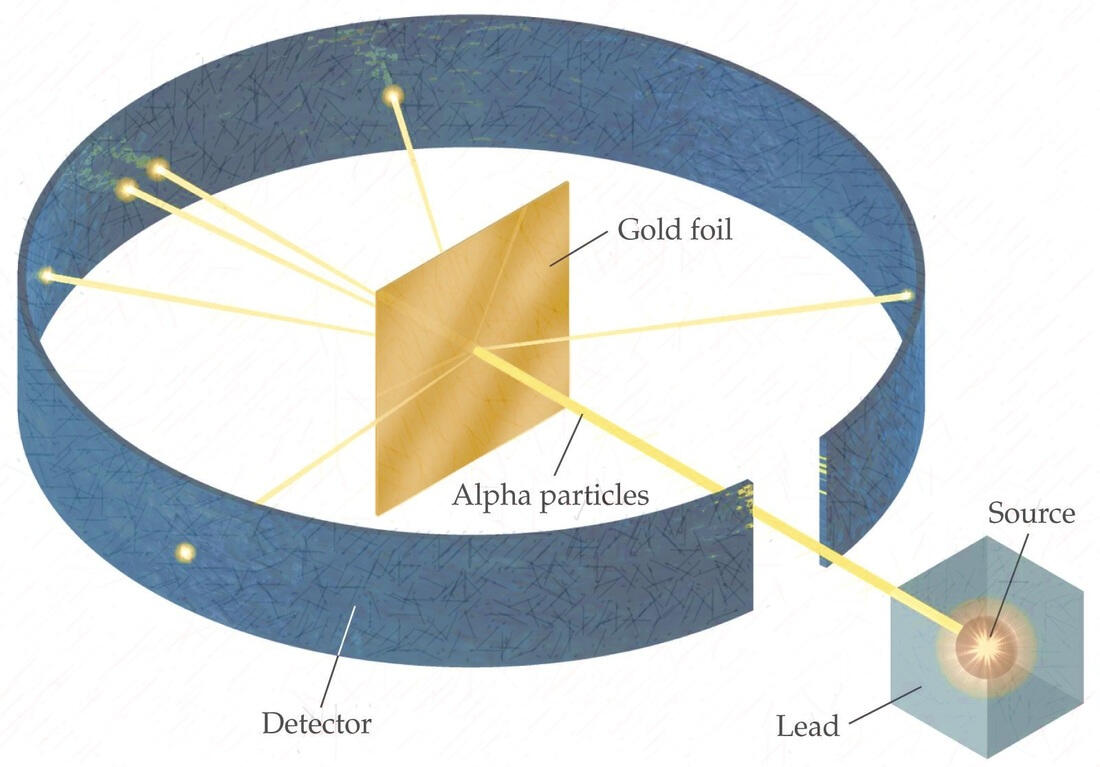
Rutherford menembakkan partikel alfa pada suatu lempeng logam tipis.Hasil eksperimennya menunjukkan bahwa sebagian besar partikel alfa diteruskan dan ada sebagian kecil yang di pantulkan atau dibelokkan.
Partikel alfa yang diteruskan mengindikasikan bahwa sebagian besar bagian atom merupakan tempat yang kosong.
Partikel alfa yang dipantulkan (dibelokkan)mengindikasikan bahwa didalam atom itu terdapat inti atom yang bermuatan positif
1 Atom terdiri dari inti atom yang bermuatan positif dan elektron yang bermuatan negatif beredar mengelilingi inti atom.
2. Atom bersifat netral muatan positif dalam inti sama dengan muatan negatif

Model Atom Rutherford
Kelemahan Teori Atom Rutherford1. ketidakmampuannya untuk menerangkan mengapa elektron tidak jatuh ke inti atom akibat gaya tarik elektrostatis inti terhadap elektron.
2.Berdasarkan Teori Maxwell: Jika elektron sebagai partikel bermuatan mengelilingi inti yang memiliki muatan berlawanan,lintasannya akan berbentuk spiral sehingga elektron akan kehilanggan tenaga dan akhirnya jatuh ke inti.
3. Hal itu berarti kehancuran bagi atom.Padahal kenyataannya atom bersifat stabil.
TEORI ATOM BOHR
Didasarkan pada penelitiannya tentang spektrum garis atom hidrogen
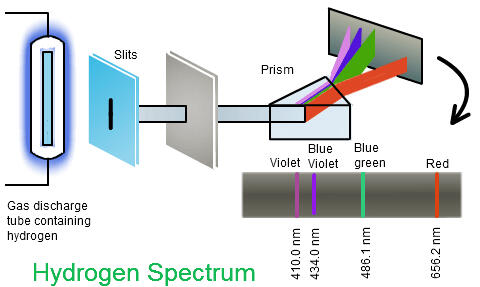
Kesimpulan percobaan :Spektrum garis menunjukkan bahwa elektron dalam atom berada pada tingkat energitertentu dalam atom
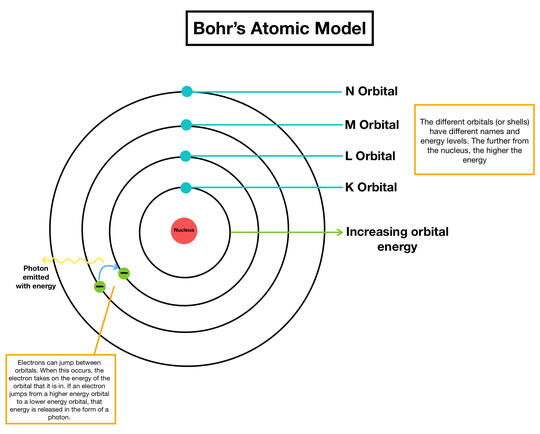
1. Elektron beredar mengelilingi intiatom pada orbit tertentu yang dikenalsebagai lintasan satsioner/tetap (kulit atom).
2. Selama elektron berada dalam lintasan stasioner,energi akan tetap sehingga tidak ada energi yang dipancarkan maupun diserap.
3. Elektron dapat berpindah dari lintasan yeng lebih rendahke lintasan yang lebih tinggi jika menyerap energi.Sebaliknya,elektron dapat berpindah dari lintasan yang lebih tinggi ke lintasan yang lebih rendah jika memancarkan energi.
Kelemahan Teori Atom Bohr1.Hanya dapat menerangkan spektrum dari atom yang mengandyng 1 elektron (atom hidrogen).
2.Tidak sesuai dengan spektrum atom yang berelektron banyak.
3. Tidak dapat menjelaskan letak elektron dengan pasti.